第5章 「I 医薬品の適正使用情報」 ここで10点獲る!②
sponsored Link
第5章 医薬品の適正使用・安全対策
Ⅰ 医薬品の適正使用情報
第5章の20問中、9~13問(平均11.5問)がここから出題されています。
しっかり傾向を押さえておきたいですね。
目次
2)~4)でだいたい3~4問出題されています。
2)製品表示の読み方
だいたい1~2問の出題です。
総論
制度開始当初は3項目がよく出題されていましたが、最近は次の①からの出題が主になっています。一応、確認だけはしておくといいでしょう。
① 副作用や事故等が起きる危険性を回避するため記載されている内容②添付文書の必読に関する事項③専門家への相談推奨に関する事項
総括、他法規

頻出は4,7,8項目です。
4項目
| 1回服用量中0.1mlを越えるアルコールを含有する内服液剤(滋養強壮を目的とするもの)については、例えば「アルコール含有○○ml以下」のように、アルコールを含有する旨及びその分量が記載されている。 |
| 運転事故等が起きる危険性を回避する目的で、アルコールを含有する全ての医薬品の外箱等には、「服用後、乗物または機械類の運転をしないこと」と記載されている。(H21) |
| 1回服用量中0.1ml未満のアルコールを含有する内服液剤(滋養強壮を目的とするもの)においては、「アルコール含有○○ml未満」のように、アルコールを含有する旨及びその分量が必須記載されている。(H22) |
| 1回服用量中0.1mL を超えるアルコールを含有する内服液剤(滋養強壮を目的とするもの)については、例えば「アルコール含有○○mL 以下」のように、アルコールを含有する旨及びその分量が記載されている。(H23) |
| アルコールを含有する内服液剤(滋養強壮を目的とするもの)については、その含有量にかかわらず、アルコールを含有する旨及びその分量が外箱等に記載されている。(H26) |
| 1回服用量中0.1mL を超えるアルコールを含有する内服液剤(滋養強壮を目的とするもの)については、アルコールを含有する旨及びその分量が記載されている。(H27) |
| 1回服用量中0.1mLを超えるアルコールを含有する内服液剤(滋養強壮を目的とするもの)については、例えば「アルコール含有○○mL以下」のように、アルコールを含有する旨及びその分量が記載されている。(H28) |
アルコールを含有する場合は1回服用分として0.1mLを超える場合だけ記載義務があると覚えておきましょう。
7項目 ※青字は穴埋め部
| 使用期限の表示については、適切な保存条件の下で製造後3年を超えて性状及び品質が安定であることが確認されている医薬品において法的な表示義務はないが、流通管理等の便宜上、外箱等に記載されるのが通常となっている(配置販売される医薬品では、「配置期限」として記載)。 |
| 適切な保存条件下で製造後2年を越えて性状及び品質が安定であることが確認されている医薬品については法的な表示義務はない。(H21) |
| 配置販売されている医薬品では、「消費期限」として記載されている。(H21) |
| 使用期限の表示については、適切な保存条件の下で製造後3年を超えて性状及び品質が安定であることが確認されている医薬品において法的な表示義務はない。(H22,23) |
| 使用期限の表示については、適切な保存条件の下で製造後( )を超えて性状及び品質が安定であることが確認されている医薬品において法的な表示義務はないが、流通管理等の便宜上、外箱等に記載されるのが通常となっている。(H25) |
| 使用期限の表示については、適切な保存条件の下で製造後( a )を超えて性状及び品質が安定であることが確認されている医薬品において法的な表示義務はないが、流通管理等の便宜上、外箱等に記載されるのが通常となっている。(H26) |
| すべての一般用医薬品は、医薬品医療機器等法により使用期限の表示が義務付けられている。(H27) |
| 配置販売される医薬品の使用期限は、「配置期限」として記載されている。(H27) |
| 使用期限の表示については、適切な保存条件の下で製造後3年を超えて性状及び品質が安定であることが確認されている医薬品において、法的な表示義務はない。(H28) |
- 適切な保存条件下で3年を超えて安定している場合は使用期限の表示義務はない
- 配置医薬品については「配置期限」として記載される
の2点を確実に押さえましょう。
※H21年には「超える」の感じも間違えていました(笑)
8項目
| 表示された「使用期限」は、未開封状態で保管された場合に品質が保持される期限であり、いったん開封されたものについては記載されている期日まで品質が保証されない場合がある。 |
| いったん開封された医薬品については記載されている期日まで品質が保証されない場合がある。(H21) |
| 表示された「使用期限」は、開封状態で保管された場合に品質が保持される期限である。(H22) |
| 表示された「使用期限」は、未開封状態で保管された場合に品質が保持される期限であり、いったん開封されたものについては記載されている期日まで品質が保証されない場合がある。(H23) |
| 表示された「使用期限」は、( b )状態で保管された場合に品質が保持される期限である。(H26) |
| 表示された「使用期限」までは、いったん開封されたものについても品質が保証される。(H27) |
医薬品の使用期限は、食品の賞味期限同様、未開封時の期限であると覚えていきましょう。
3)安全性情報など、その他の情報
だいたい2問出題されます。
総論、【緊急安全性情報】、【安全性速報】
緊急安全性情報について、2項目、3項目を押さえましょう。
2項目(H27年から問題の手引きが改訂されました。緑字が改訂箇所)
| 医薬品、医療機器又は再生医療等製品について緊急かつ重大な注意喚起や使用制限に係る対策が必要な状況にある場合に、厚生労働省からの命令、指示、製造販売業者の自主決定等に基づいて作成される。製造販売業者及び行政当局による報道発表、(独)医薬品医療機器総合機構(以下「総合機構」という。)による医薬品医療機器情報配信サービスによる配信、製造販売業者から医療機関や薬局等への直接配布、ダイレクトメール、ファックス、電子メール等による情報提供(1か月以内)等により情報伝達されるものである。A4サイズの黄色地の印刷物で、イエローレターとも呼ばれる。 |
| A4サイズの黄色地の印刷物で、ドクターレターとも呼ばれる。(H21,24) |
| この情報は、医薬品のみを対象とするものである。(H21) |
| 厚生労働省からの指示に基づいて、製薬企業等から医薬関係者に、4ヶ月以内に原則として直接配布されるものである。(H21) |
| 緊急安全性情報は、独立行政法人医薬品医療機器総合機構からその医薬品又は医療機器を取り扱う医薬関係者に対して、直接配布し、情報伝達される。(H22) |
| 薬品又は医療機器について重要かつ緊急な情報伝達が必要な場合(予期せぬ重大な副作用等) に、( a )からの指示に基づいて、製造販売元の製薬企業等からその医薬品又は医療機器を取り扱う医薬関係者に対して、( b )に原則として直接配布し、情報伝達されるものである。A4サイズの( c )地の印刷物で、ドクターレターとも呼ばれる。(H23) |
| 医薬品又は医療機器について重要かつ緊急な情報伝達が必要な場合に、その医薬品等を取り扱う医薬関係者に対して、厚生労働省から4週間以内に原則として直接配布し、情報伝達されるものである。(H24) |
| 「安全性速報」は、A4サイズの黄色地の印刷物で、イエローレターとも呼ばれる。(H26) |
| 「緊急安全性情報」は、医薬品又は医療機器について緊急かつ重大な注意喚起や使用制限に係る対策が必要な状況にある場合に、厚生労働省から医療機関や薬局等へ1ヶ月以内に直接配布により情報伝達されるものである。(H26) |
| A4サイズの青色地の印刷物で、ブルーレターとも呼ばれる。(H27) |
| 都道府県の命令により、製造販売業者からその医薬品又は医療機器を取り扱う医薬関係者に対して直接配布される。(H27) |
| 医薬品又は医療機器について緊急かつ重大な注意喚起や使用制限に係る対策が必要な状況にある場合に配布される。(H27) |
| 緊急安全性情報は、医薬品、医療機器又は再生医療等製品について緊急かつ重大な注意喚起や使用制限に係る対策が必要な状況にある場合に、厚生労働省からの命令、指示、製造販売業者の自主決定等に基づいて作成される。(H28) |
- 緊急安全性情報 :黄色地(イエローレター)
- 厚生労働省の命令、指示、製造販売業者の自主決定で、作成
- 1か月以内に直接配布するのは製造販売業者
の3つのポイントを押さえましょう!
3項目 緊急安全性情報について
| 医療用医薬品や医家向け医療機器についての情報伝達である場合が多いが、小柴胡湯による間質性肺炎に関する緊急安全性情報(平成8年3月)のように、一般用医薬品にも関係する緊急安全性情報が発出されたこともある。 |
| これまで一般用医薬品について発出されたことはない。(H21) |
| 2000年11月に塩酸フェニルプロパノールアミン含有医薬品による出血性脳卒中に関する緊急安全性情報が発出された。(H24) |
| 一般用医薬品に関係する緊急安全性情報が発出されたことがある。(H24,27) |
| 「緊急安全性情報」は、医療用医薬品についての情報伝達であり、一般用医薬品には関係しない。(H26) |
| 緊急安全性情報は、医療用医薬品や医家向け医療機器についての情報伝達であり、一般用医薬品に関係する緊急安全性情報が発出されることはない。(H28) |
| 慢性肝炎患者が小柴胡湯を使用して出血性脳卒中が発症し、死亡を含む重篤な転帰に至った例があったことから、1996年3月、厚生省(当時)より関係製薬企業に対して緊急安全性情報の配布が指示された。(H28) |
出題の仕方がややこしいですが、この2点だけしっかり押さえておけば大丈夫です!
【医薬品・医療機器等安全性情報】【医薬品医療機器情報提供ホームページ】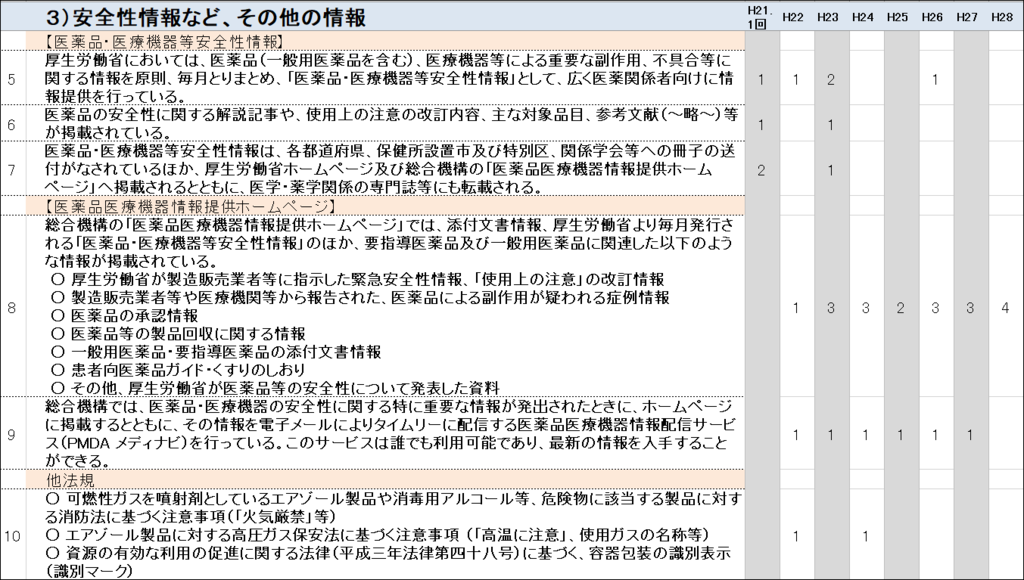
5項目
| 厚生労働省においては、医薬品(一般用医薬品を含む)、医療機器等による重要な副作用、不具合等に関する情報を原則、毎月とりまとめ、「医薬品・医療機器等安全性情報」として、広く医薬関係者向けに情報提供を行っている。 |
| 日本製薬団体連合会と日本医療機器産業連合会が、医薬品や医療機器等による重大な副作用、不具合等に関する情報を原則、毎月とりまとめ、提供を行っているものである。(H21) |
| 厚生労働省においては、医薬品、医療機器等による重要な副作用、不具合等に関する情報を毎週とりまとめ、「医薬品・医療機器等安全性情報」として、医薬関係者向けに情報提供を行っている。(H22) |
| 一般用医薬品に関する情報が掲載されることはない。(H23) |
| 厚生労働省において、医薬品、医療機器等による重要な副作用、不具合等に関する情報を原則、毎月とりまとめ、広く医薬関係者向けに情報提供を行っている。(H23) |
| 厚生労働省では、医薬品、医療機器等による重要な副作用、不具合等に関する情報を原則、毎月とりまとめ、「医薬品・医療機器等安全性情報」として広く医薬関係者向けに情報提供を行っている。(H26) |
厚生労働省において、一般用医薬品を含む医薬品等についてとりまとめられる。ということです。
ただし、問題の手引きが改訂されてからは出題されていません。そろそろ出題される頃かもしれませんね。
8項目
|
総合機構の「医薬品医療機器情報提供ホームページ」では、添付文書情報、厚生労働省より毎月発行される「医薬品・医療機器等安全性情報」のほか、要指導医薬品及び一般用医薬品に関連した以下のような情報が掲載されている。 ○ 厚生労働省が製造販売業者等に指示した緊急安全性情報、「使用上の注意」の改訂情報 ○ 製造販売業者等や医療機関等から報告された、医薬品による副作用が疑われる症例情報 ○ 医薬品の承認情報 ○ 新医薬品等の製品回収に関する情報 ○ 一般用医薬品・要指導医薬品の添付文書情報 ○ 患者向医薬品ガイド・くすりのしおり ○ その他、厚生労働省が医薬品等の安全性について発表した資料 |
|
医薬品等の製品回収に関する情報が掲載されている。(H22,23,26) |
| 企業や医療機関等から報告された、医薬品による副作用が疑われる症例情報が掲載されている。(H23,25) |
| 新医薬品(新一般用医薬品を含む)等の承認情報が掲載されている。(H23) |
| 「使用上の注意」の改訂情報が掲載されている。(H24) |
| 一般用医薬品の添付文書情報が掲載されている。(H24) |
| 添付文書情報、医薬品・医療機器等安全性情報のほか、緊急安全性情報や「使用上の注意」の改訂情報などが掲載されている。(H25) |
| 添付文書情報は掲載されているが、「医薬品・医療機器等安全性情報」は掲載されていない。(H26) |
| 新医薬品(要指導医薬品及び新一般用医薬品を含む。)等の承認情報が掲載されている。(H26) |
| 医薬品の承認情報が掲載されている。(H27) |
| 製造販売業者等や医療機関等から報告された、医薬品による副作用が疑われる症例情報が掲載されている。(H27) |
| 一般用医薬品・要指導医薬品の添付文書情報が掲載されている。(H27) |
| 一般用医薬品・要指導医薬品の添付文書情報(H28) |
| 患者向医薬品ガイド・くすりのしおり(H28) |
| 登録販売者名簿(H28) |
| 薬剤師名簿(H28) |
ほとんどがYesですが、名簿がホームページで閲覧出来たらおかしいでしょ!プライバシーはどこ行ったんだ?って話ですよね。
9項目
| 総合機構では、医薬品・医療機器の安全性に関する特に重要な情報が発出されたときに、ホームページに掲載するとともに、その情報を電子メールによりタイムリーに配信する医薬品医療機器情報配信サービス(PMDA メディナビ)を行っている。このサービスは誰でも利用可能であり、最新の情報を入手することができる。 |
| 独立行政法人医薬品医療機器総合機構では、医薬品・医療機器の安全性に関する情報が発出されたときに、医薬品医療機器情報提供ホームページへの掲載と同時に、その情報を電子メールにより配信するサービスを行っている。(H22) |
| 医薬品・医療機器の安全性に関する情報が発出されたときに、ホームページへの掲載と同時に、その情報を電子メールにより配信するサービスを行っているが、登録販売者は配信登録を行うことができない。(H23) |
| 医薬品・医療機器の安全性に関する情報が発出されたときに、ホームページへの掲載と同時に、その情報を電子メールにより配信するサービスが行われている。(H24) |
| 医薬品・医療機器の安全性に関する情報が発出されたときに、本ホームページへの掲載と同時に、その情報を電子メールで配信するサービスを行っている。(H25) |
| (独)医薬品医療機器総合機構では、医薬品・医療機器の安全性に関する情報について電子メールにより配信する医薬品医療機器情報配信サービスを行っており、薬局又は医薬品の販売業に従事する登録販売者は配信登録を行うことができる。(H26) |
| 医薬品医療機器情報配信サービスは、薬局又は医薬品の販売業に従事する専門家(薬剤師及び登録販売者)のみ配信登録できる。(H27) |
PMDAメディナビはだれでも利用(登録)可能です、ということを聞かれます。簡単ですよね。
4)購入者等に対する情報提供への活用
今までのところ平成25年に1問出たくらいです。ざっと確認しておきましょう。

さあ、なかなかボリュームがあると感じたでしょうか。でも、ポイントを押さえるだけなので、数回さらえばきっと大丈夫です。
きっちり10点は獲りましょう!!
============================
第5章関連リンク====================
Ⅰ 医薬品の適正使用情報(10~12問)
2)製品表示の読み方(1~2問)、3)安全性情報など、その他の情報(1~2問)
Ⅱ 医薬品の安全対策(2~4問)
1 医薬品の副作用情報等の収集、評価及び措置(0~2問)
2 医薬品による副作用等が疑われる場合の報告の仕方(1~2問)
Ⅲ 医薬品の副作用等による健康被害の救済(3~4問)